Science class 10th in hindi रेडॉक्स अभिक्रिया
रेडॉक्स अभिक्रिया:-
ऐसी समग्र अभिक्रियाएँ जिसमे ऑक्सीकरण (Oxidation) व अपचयन ( Reduction) क्रियायें साथ-साथ घटित होती है अपचयोपचय (रेडॉक्स ) Redox अभिक्रिया कहलाती है ।
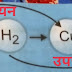
जैसे :- कॉपर ऑक्साइड की क्रिया हाइड्रोजन से कराने पर ऑक्सीकरण और अपचयन दोनों क्रियाएं प्राप्त होती है ।
अपचयन अभिक्रिया -
वह क्रिया जिसमे परमाणु या आयन एक से अधिक इलेक्ट्रान ग्रहण करता है अपचयन क्रिया कहलाती है। अर्थात किसी पदार्थ में ऋणविद्दुती तत्व का निकल जाना ( ऑक्सीजन ) या धनविद्दुती तत्व (हाइड्रोजन ) जुड़ना अपचयन ( अवकरण ) कहलाता है।
जैसे -
Fe3 + e- → Fe2+
ऑक्सीकरण व अपचयन में अंतर
|
ऑक्सीकरण |
अपचयन |
|
इसमें ऑक्सीजन का योग होता है |
इसमें ऑक्सीजन का निष्कासन होता है |
|
इसमें हाइड्रोजन का निष्कासन होता है। |
इसमें हाइड्रोजन का योग होता है |
|
इसमें अधातु का योग होता है। |
इसमें धातु का योग होता है। |
|
इसमें संयोजकता में वृद्धि होती है। |
इसमें संयोजकता में कमी होती है। |
|
इसमें इलेक्ट्रानो में कमी व् ऑक्सीकरण संख्या में वृद्धि होती है। Na → Na+ + e-
|
इसमें इलेक्ट्रानो में वृद्धि व् ऑक्सीकरण संख्या में कमी होती है। Fe3 + e- → Fe2+ |
- धातुओ के निष्कर्षण में ।
- उर्जा प्राप्त करने में।प्रकाश संश्लेषण में।
- विद्दुत रासायनिक सेल बंनाने में ।
- अंतरिक्ष यानो को ऊर्जा प्रदान करने में ।
ऑक्सीकरण संख्या ➩
किसी तत्व के एक परमाणु पर स्थित धन या ऋण आवेशों की संख्या को उस तत्व की ऑक्सीकरण संख्या कहते है। जबकि ये आवेश वास्तविक अथवा काल्पनिक हो सकते। ऑक्सीकरण संख्या को ऑक्सीकरण अवस्था भी कहते है।
जैसे ➤ सोडियम क्लोराइड में Na+Cl- सोडियम की ऑक्सीकरण संख्या +१ है और क्लोरीन की ऑक्सीकरण संख्या एक है। किसी तत्व की ऑक्सीकरण संख्या शून्य अथवा धनात्मक या ऋणात्मक हो सकती है। ऑक्सीकरण संख्या शून्य का अर्थ है की तत्व उदासीन है।
ऑक्सीकरण संख्या को निर्धारित करने के नियम ➩
ऑक्सीकरण संख्या ज्ञात करने के नियम निम्नलिखित हैं➩
- जब दो असमान परमाणु इलेक्ट्रॉनों का साझा करके बनाते हैं तो ताजा किए गए इलेक्ट्रॉन अधिक ऋण विद्युत परमाणु के साथ गिने जाते हैं। जैसे हाइड्रोजन तथा क्लोरीन के योग से HCl अणु बनता है।
- जब दो समान परमाणु साझा कर अनु बनाते हैं तो साझा किए गए इलेक्ट्रॉन दोनों में समान रूप से विभाजित रहते हैं अतः दोनों परमाणुओं में से कोई भी आवश्यक प्रतीत नहीं होता है जैसे हाइड्रोजन अणु H:H में इलेक्ट्रान युग्म दोनों परमाणुओं में समान साझे में है अतः हाइड्रोजन अनु में ऑक्सीकरण संख्या शून्य है।
- मुफ्त या संयुक्त तत्वों के परमाणु की ऑक्सीकरण संख्या शून्य होती है तथा एक प्रमाण भी आयन की ऑक्सीकरण संख्या उसके ऊपर विद्युत आवेश ओं की संख्या के बराबर होती है जैसे H2 P4 S8 O2 F2 Br2 व् Ag में सभी परमाणुओं की ऑक्सीकरण संख्या शून्य है।



















Thanks
जवाब देंहटाएं